近年随着人口老龄化问题不断加剧,导致医疗成本不断增加,人们对慢病防治、美容抗衰等需求日渐强烈。日本作为全球少数将干细胞获批应用的国家之一,其在细胞治疗领域发展迅速,自2012~2018年间,共有三位日本科学家(即山中伸弥、大隅良典、本庶佑)在干细胞、细胞自噬机制、免疫细胞治疗方面取得突出成果,并获得了诺贝尔生理学和医学奖,这也使日本在细胞治疗产品研发和政策方面走在世界前列。
但由于干细胞的特殊性,比如作用机制及治疗复杂性等,如何监管以及能否批准这些产品上市,监管机构面临很大的行政管理压力。在过去的十余年间,日本颁布了多项法规,以规范干细胞等再生医疗产品。下面国际干细胞小编帮大家汇总了日本在细胞监管、审批机制等方面的亮眼成绩,以供大家参考。
在日本“细胞治疗产品”被称为“再生医疗产品”,再生医学起源于胚胎学中的干细胞生物学,其治疗理念是通过干细胞,恢复受损器官和组织的功能。
干细胞疗法是将来自自体或同种异体活细胞,经过体外加工及处理后,回输到患者体内,以达到美容抗衰、慢病防治等目的。
日本独立行政法人医药品医疗器械综合机构(PMDA)将其作为独立于药品、医疗器械之外的第三类产品进行监管。关于日本干细胞已获批的项目,国际干细胞研究医学部之前做过详细介绍,大家可阅读原文:全面汇总:日本获批干细胞类型及适应证,涵盖糖尿病、关节炎、抗衰等多领域
干细胞技术具有多样性、复杂性,其产业健康发展依赖于完善、规范的监管制度。当前全球不同国家对干细胞的监管体系和框架有所差异,但总体可分为两类:
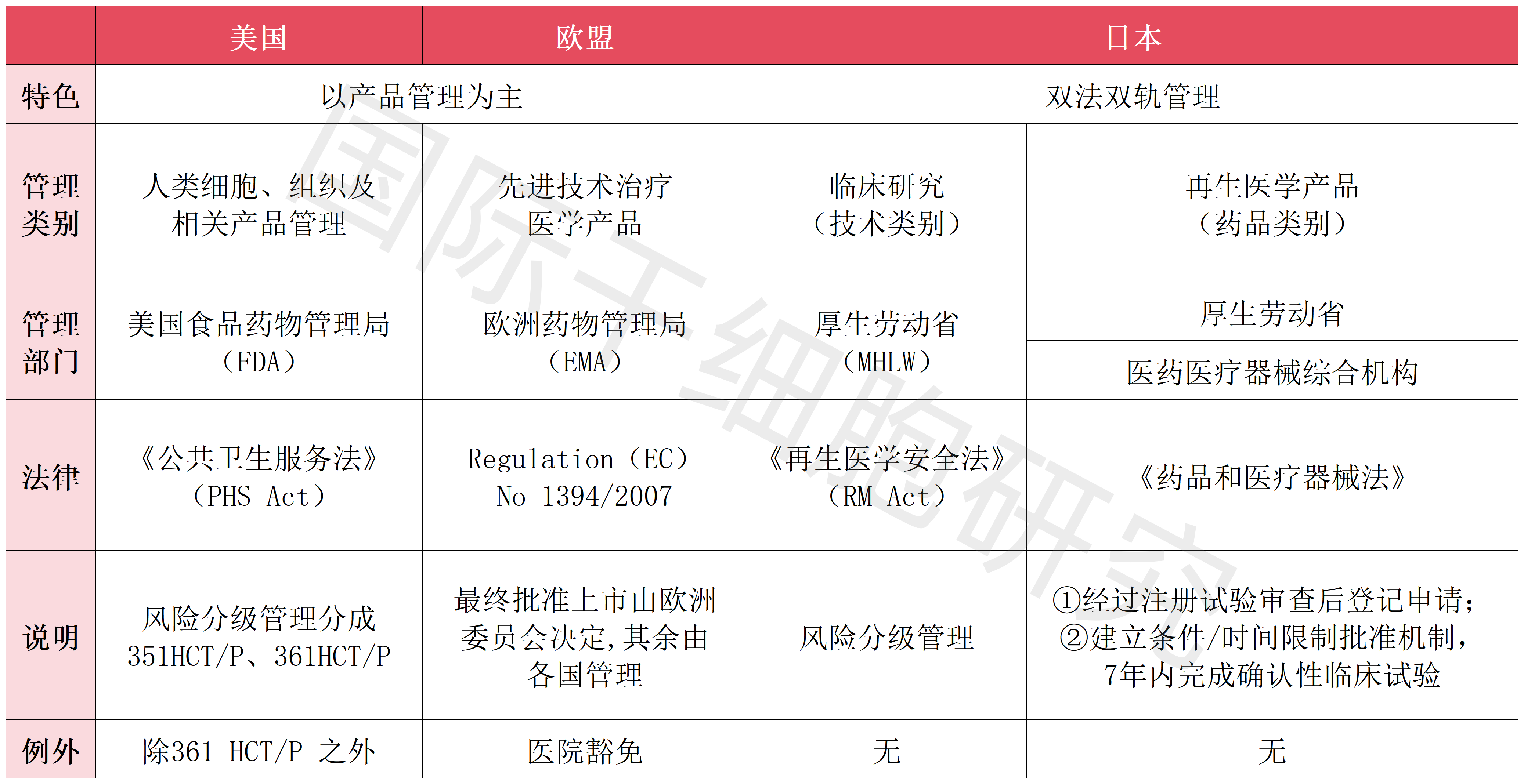
1、按新药进行注册,由药品监督管理部门监管:典型代表是美国、欧盟。
2、按新药和医疗技术分类注册,由药品监督管理部门和卫生健康监督管理部门分开监管:典型代表为日本,由厚生劳动省(MHLW)、医药医疗器械综合机构(PMDA)分开监管(详见下表)。
表1 美国、欧盟、日本对细胞治疗监管政策的对比
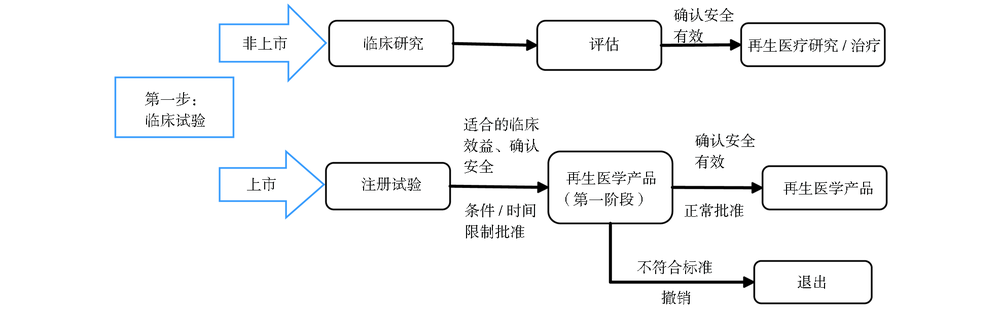
日本政府对于细胞治疗产品,采取“医疗技术”以及“干细胞新药”分开管理模式,通过设立职责明确的监管机构、制定分类别的法律法规、打通全流程的监管审批步骤,构建了两条完整的“双轨制监管”模式。
在医疗机构执行的临床研究和应用,被认定为医疗技术,仅在获得认证的医疗机构进行,不可用于上市许可,由厚生劳动省按照《再生医学安全法》进行监管。
根据细胞来源、细胞处理方式、适用范围等风险等级不同,将再生医疗分为三类,即第一类再生医疗(如胚胎干细胞、多能诱导干细胞等)、第二类再生医疗(如自体脂肪间充质干细胞等)、第三类再生医疗。最高风险的第一类再生医疗临床研究和应用,需额外通过再生医学认证委员会和厚生劳动省,进行为期90天的审查。
由企业开发、以取得上市销售许可为目的的干细胞新药,上市后成为再生医学产品,须经药品与医疗器械局(PMDA)审查,按照《药品和医疗器械法》进行注册试验和上市审批。
经过小规模临床试验提示安全且可能有效的产品,可提出“有条件/期限上市许可”申请,9个月内由PMDA做出审批决定。获得许可的产品,可进行市场化运作,并收集治疗病例信息,在7年内验证其安全性和有效性后,方可申请最终上市。
图1 日本双轨监管流程图
▲图源“CHINA BIOTECHNOLOGY”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
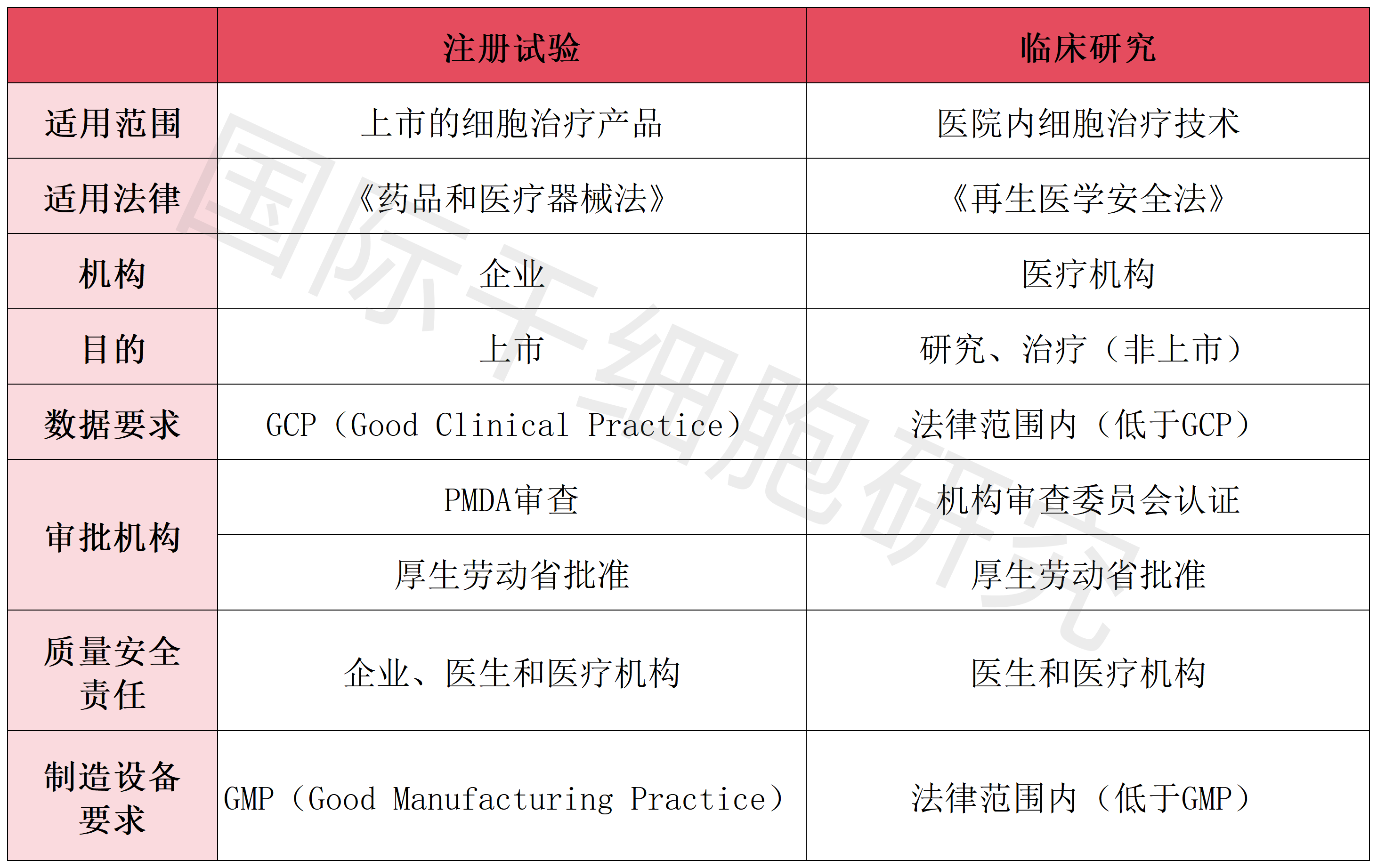
虽然日本干细胞执行双轨制管理模式,但二者并不构成冲突,两类临床研究均有明确的监管流程。
在取得资质的医疗机构内开展的细胞治疗,将由日本厚生劳动省,依据《再生医学安全法》对其进行监管。总之,无论是技术还是产品,管辖权都集中在厚生劳动省。
日本细胞治疗产品由PMDA根据《药物和医疗器械法案》进行监管,其药品评估中心,下设细胞组织加工制品专门委员会,具体负责审批事务。对于产品上市,PMDA有上市前的审查权和上市后的风险控制义务。
表2 注册试验与临床研究比较
近年随着再生医学的不断发展,以干细胞为代表的再生医疗产品逐渐成为各国尖端科技的“必争之地”。日本作为细胞治疗技术研发强国之一,细胞治疗产品管理在法规层面和技术层面都有创新之处。尤其是“双轨”监管制度的执行,让干细胞的监管职责更加清晰、分工更加明确,尽可能的控制了产品风险,值得我们借鉴。如果您也有慢病防治、美容抗衰或提升免疫力等需求,且想寻求日本干细胞的帮助,可以咨询国际干细胞研究医学部。
本文为“国际干细胞研究”原创,转载需授权
[1]DIAO Yuwei,et al.Management of Cell Therapy Products in Japan and Its Implications for China[J]. Progress in Pharmaceutical Sciences,2019,43(12):908-913.
https://pps.cpu.edu.cn/article/app/id/578c9402-24d6-43a4-ad05-e3bc2633849a
[2]LI Yu,et al.The Experience and Enlightenment of Cell Therapy Regulation Dual-track System in Japan[J].China Biotechnology,2020,40(1-2):174-179.
https://manu60.magtech.com.cn/biotech/CN/10.13523/j.cb.1906020
[3]Enosawa S.Clinical Trials of Stem Cell Therapy in Japan: The Decade of Progress under the National Program. J Clin Med. 2022 Nov 28;11(23):7030.
https://www.mdpi.com/2077-0383/11/23/7030
[4]聂永星等.日本干细胞双轨制监管对中国的经验借鉴[J].云南大学学报:自然科学版, 2020, 42(S02):5.
[5]陈云等.韩国与日本干细胞药品审批,监管及对我国的启示[J].中国新药杂志,2018,27(3):6.
1. 添加医学顾问微信,扫描☟二维码
2. 备注【您想咨询的问题】

我们致力于干细胞科普知识的推广与普及,专注于干细胞最新资讯提供和干细胞治疗专家咨询服务。
免责声明:本站内容仅供参考,不作为诊断及医疗依据