干细胞产品作为一类“活”的细胞,代表了人类医药发展史上极其复杂且颠覆性的产品,其产业健康发展依赖于完善、规范的监管制度。近年我国虽然在干细胞基础研究领域发展迅速、成果频出,但受限于监管框架等因素的制约,我国干细胞的产业发展明显滞后于日本、美国等发达国家。
日本得益于完善的法律体系和特殊的审批政策,多年来在细胞治疗产品的技术研发和监管政策方面,一直处于全球领先地位。那么同为亚洲国家,我国和日本在干细胞临床研究、政策监管方面有何异同?日本有哪些值得我们借鉴之处?且听国际干细胞小编一一道来,相信之后您自有判断。
我国药品监督管理局(SDA)就以“治疗用生物制品”,受理了我国初代一类干细胞创新药物——“重组人干细胞因子注射液”。
由于监管部门基本奉行“干细胞是医疗手段而非药物”的监管思想,国家食品药品监督管理总局开始收紧干细胞新药的临床试验申请。
国内开始接受“干细胞是药物,需通过谨慎实验,并严格监管”这一主导思想,中国大陆境内所有的干细胞治疗活动被迫叫停。
得益于干细胞在提高机体免疫力、修复肺损伤、对抗长新冠后遗症等方面的亮眼表现,国家逐步放开干细胞政策。
我国已有60余项间充质干细胞(MSC)药物临床试验(不包含造血干细胞),获国家药品监督管理局药品审评中心默许,涵盖骨关节炎、糖尿病足溃疡、肺纤维化、类风湿关节炎、银屑病、急性呼吸窘迫综合征、移植物抗宿主病、卒中、克罗恩病、肝衰竭等多个病种。随着临床试验数量的增加,势必会推动干细胞领域的发展。如果您还想了解干细胞政策的更多资讯,可以咨询国际干细胞研究医学部。
总之,上述政策对推动我国干细胞研究具有积极意义,标志着中国干细胞临床研究的大幕终于从监管层面再次拉开。但我国细胞领域发展仍存在一定的问题,比如细胞治疗范围界定和监管部门权责划分不够清晰,医疗机构、企业、监管部门、患者的相应权利和义务不够明确等。
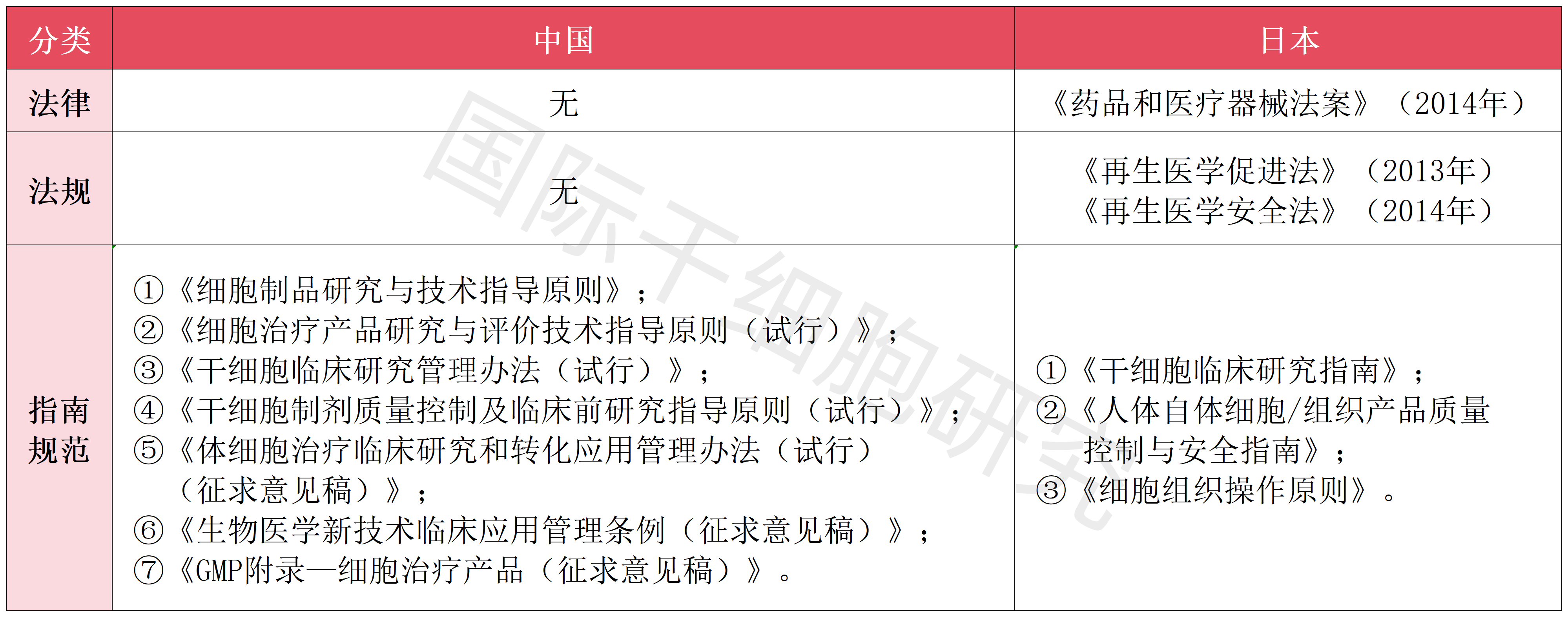
表1 中日细胞治疗产品监管法规对比
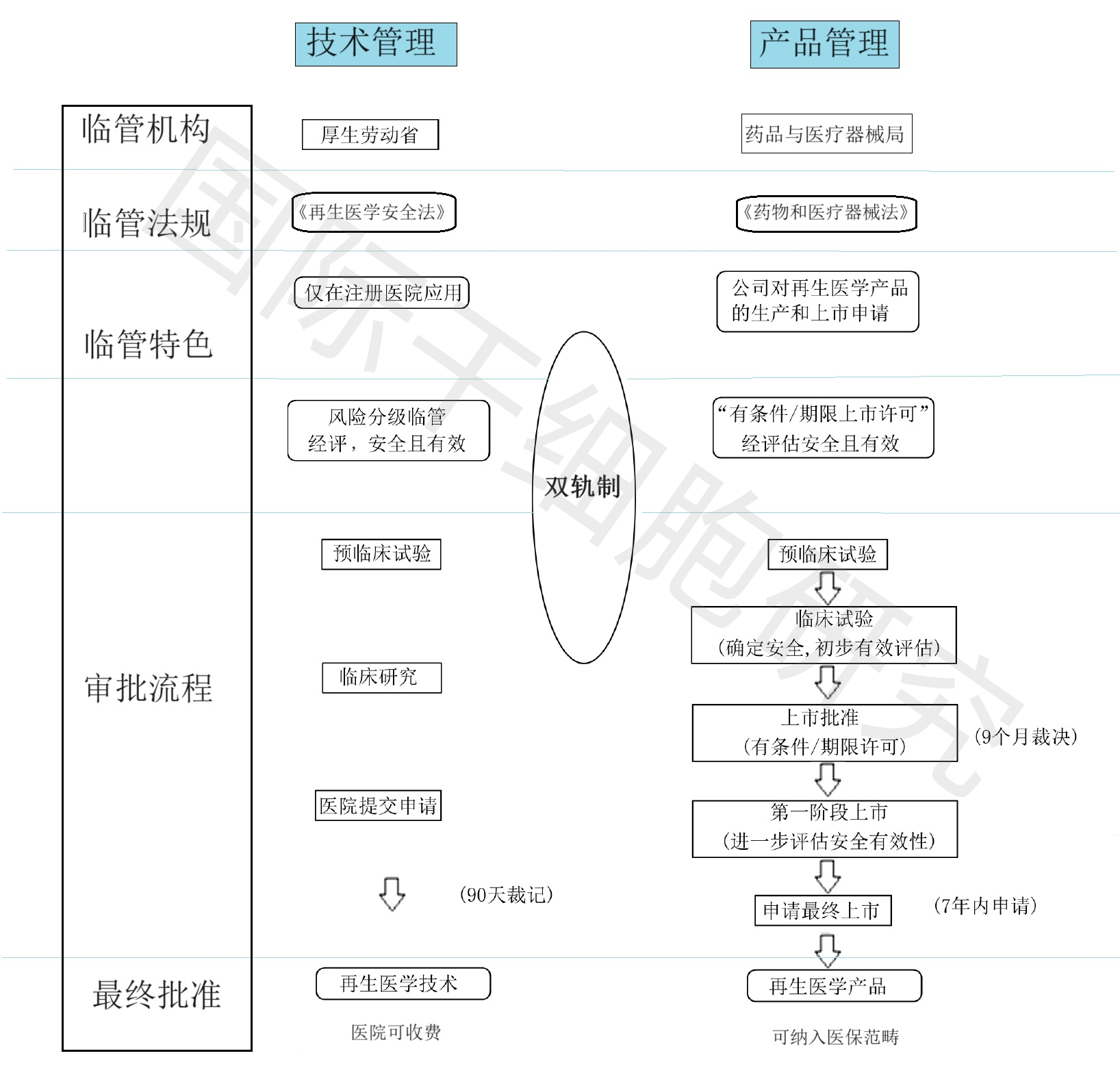
日本干细胞疗法是按“新药”和“医疗技术”分类注册,并采取“双轨监管模式”,遵循《再生医学安全法》和《药品和医疗器械法》,由“药品监督管理部门”和“卫生健康监督管理部门”分开监管。
我国干细胞按照新药和医疗技术分类监管,在顶层监管框架上与日本接近。2019年,我国发布了《关于做好2019年干细胞临床研究监督管理工作的通知》,明确了干细胞临床研究和应用规范采取“类双轨管理模式”,即由“国家药监局”和“卫健委”共同开展,以建立符合我国国情的干细胞技术规范。
1、我国干细胞临床研究和应用规范:由“国家药监局”和“卫健委”共同监管。其中,国家卫健委负责监管干细胞治疗;国家食品药品监督管理总局(CFDA)负责干细胞药品的审批和监管。
2、我国干细胞研究的相关伦理监管:由国家卫健委、各医疗机构的伦理委员会、科技部等共同负责。
1、厚生劳动省(MHLW):在取得资质的医疗机构内开展的细胞治疗,将由日本厚生劳动省,依据《再生医学安全法》对其进行监管。总之,无论是技术还是产品,管辖权都集中在厚生劳动省。
我国细胞治疗产品的注册主要历经如下步骤:
①需由申请人,向国家药品监督管理局(NMPA)药品审评中心(CDE)提出申请。
②CDE进行现场核查后,最终作出是否同意审批的决定。
③如果同意审批,会向临床试验机构颁发《临床试验批件》。
日本采取“医疗技术”以及“干细胞新药产品”分开管理模式,审批路径如下:
1、技术管理(即临床研究)
①医疗机构进行临床研究时,应向厚生劳动省的再生医学委员会,提交一份研究计划;
②厚生劳动省进行审查,审查通过后给予批准。对于1类(高风险)产品,除了再生医学委员会的评估,厚生劳动省还会在90天内,咨询健康科学委员会(Health Science Council),根据健康委员会意见做出判断。
③经过批准之后,医疗机构方可进行再生医学治疗,日本允许医疗机构对患者收取相应费用。
2、产品管理:注册试验
①申请人需向药品与医疗器械局(PMDA),提出申请;
②经过PMDA审查,提出是否批准的建议,再将建议提交至厚生劳动省;
③厚生劳动省根据审查结果,咨询制药与食品卫生委员会(Pharmaceutical & Food Sanitation Council),做出最终决定。
条件性限制性准入许可时间最长为 7 年,日本允许企业在“有条件/期限上市”期间可针对产品收费。在证明细胞治疗产品临床试验与应用有效性之后,7年内产品可以再次申请作为正式的再生医学产品长期上市,或退出市场(详见下图)。
图1 日本再生医学产品审批路径
▲图源“维普网”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
日本作为细胞治疗技术研发强国之一,在细胞产品的法律管理及技术层面都有其创新之处。而我国近年来干细胞虽迎来井喷式的发展,且各项利好政策相继出台,但仍存在法律法规体系不完善、信息管理追溯不规范、风险防控体制不健全等不可忽视的问题。国际干细胞小编也期望,我国能借鉴日本在干细胞产品临床试验管理、产品审批上市等方面的经验,尽快完善相关法律法规、加强审查力度、加快审批路径、加强国际合作,提高干细胞产品的安全性、有效性及质量可控性水平,从而推动我国细胞治疗领域的健康发展,尽快赶超日美等强国,以惠及更多的患者!如果您也饱受慢病困扰,或有美容抗衰等需求,可以咨询国际干细胞研究医学部,以获取国内外干细胞研究应用的更多讯息。
本文为“国际干细胞研究”原创,转载需授权
[1]DIAO Yuwei,et al.Management of Cell Therapy Products in Japan and Its Implications for China[J].Progress in Pharmaceutical Sciences,2019,43(12):908-913.
https://pps.cpu.edu.cn/article/app/id/578c9402-24d6-43a4-ad05-e3bc2633849a
[2]LI Yu,et al.The Experience and Enlightenment of Cell Therapy Regulation Dual-track System in Japan[J].China Biotechnology,2020,40(1-2):174-179.
https://manu60.magtech.com.cn/biotech/CN/10.13523/j.cb.1906020
[3]聂永星等.日本干细胞双轨制监管对中国的经验借鉴[J].云南大学学报:自然科学版,2020,42(S02):5.
[4]陈云等.韩国与日本干细胞药品审批,监管及对我国的启示[J].中国新药杂志,2018,27(3):6.
1. 添加医学顾问微信,扫描☟二维码
2. 备注【您想咨询的问题】

我们致力于干细胞科普知识的推广与普及,专注于干细胞最新资讯提供和干细胞治疗专家咨询服务。
免责声明:本站内容仅供参考,不作为诊断及医疗依据